- Carcinoma gástrico primario
- Carcinoma en el estómago operado (carcinoma del muñón gástrico)
- En caso de oligometástasis en el marco de un enfoque multimodal dentro de estudios y extirpación de todas las localizaciones metastásicas.
Situación especial metástasis peritoneales:
Tras terapia sistémica neoadyuvante, resección oncológica (gastrectomía/resección gástrica subtotal) con linfadenectomía D2 y márgenes de resección libres de tumor, así como resección completa de las metástasis peritoneales (cirugía citorreductora) más quimioterapia intraperitoneal hipertérmica, si con ello se puede lograr una resección completa de todas las partes tumorales macroscópicamente visibles y el PCI (Índice de Carcinomatosis Peritoneal) es inferior a 12.
- Las metástasis descubiertas por primera vez intraoperatoriamente pueden resecarse de manera análoga a la guía del esófago – si son R0-resecables.
- En caso de enfoque terapéutico curativo y resecabilidad local, existe básicamente una indicación quirúrgica siempre que no existan factores de riesgo masivos (enfermedades previas o estado general del paciente, véase contraindicaciones).
- En tumores localmente avanzados de los estadios II y III (cT1/cT2N+ así como cT3/cT4Nx resecable) debe realizarse una quimioterapia perioperatoria.
- En caso de enfoque terapéutico paliativo puede estar indicada la gastrectomía en casos raros (p. ej., hemorragia, perforación, estenosis).
- La extensión de la resección (gastrectomía total versus subtotal) está determinada por la localización/extensión del tumor y la distancia de seguridad requerida por el tipo histológico.
- Para lograr márgenes de resección libres de tumor (R0), excepto en carcinomas mucosos (T1a N0 M0), debe mantenerse en general una distancia de seguridad proximal en el estómago de 5 cm (tipo intestinal según Lauren) o 8 cm (tipo difuso según Lauren) in situ. En caso de no alcanzarse la distancia de seguridad, según la actualización de las guías S3 (agosto 2019) debe realizarse un corte rápido.
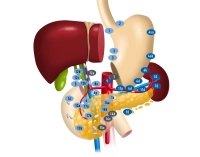
Linfadenectomía
La extirpación de los ganglios linfáticos de los compartimentos I y II se denomina LAD D2 y representa la linfadenectomía estándar en el carcinoma gástrico. Puede considerarse como el estándar de oro.
Basado en la clasificación japonesa (numeración), los ganglios linfáticos se agrupan en varios compartimentos. Los ganglios linfáticos D1 abarcan las estaciones 1 a 6, el compartimento D2 además las estaciones 7 a 11.
Los GL de la estación 12 se incluyen en la resección oncológica en carcinomas distales localizados en la curvatura menor. Los GL en el conducto biliar principal (estación 12b, se considera M1) a menudo no se disecan para evitar lesiones/desvascularización del mismo.
En el compartimento D3 se encuentran los grupos 12 a 15 y por definición no son estaciones de ganglios linfáticos regionales del estómago. Dado que pronósticamente se valoran como metástasis distantes, se clasifican como M1 LYM en caso de afectación.
Para obtener una clasificación pN0, la UICC requiere un número mínimo de 16 ganglios linfáticos regionales a examinar. En la guía S3 alemana, el número de ganglios linfáticos deseado se indica como ≥ 25.
Situación especial carcinoma gástrico temprano/ Indicaciones para la resección endoscópica
Se define como carcinoma gástrico temprano a un tumor que, independientemente del estado de los ganglios linfáticos, la extensión superficial y la metastasización distante, está limitado a la mucosa y submucosa de la pared gástrica. La muscularis propia del estómago está libre de tumor por definición.
Se observan diferencias en los carcinomas tempranos en la frecuencia de una posible metastasización en ganglios linfáticos. Los tumores que ya han infiltrado las capas profundas de la mucosa (m3) o la submucosa no entran en consideración para una terapia endoscópica, ya que se debe contar con una probabilidad del 4-20% de metástasis en GL.
Aproximadamente el 5% de los pacientes presentan un carcinoma gástrico temprano del tipo mucoso (pT1/2m), en el que es posible un enfoque terapéutico curativo mediante una resección endoscópica, ya que la probabilidad de metastasización en ganglios linfáticos es extremadamente baja. Los pacientes afectados tienen un pronóstico excelente con una tasa de supervivencia a cinco años de > 90 %.
Los siguientes criterios deben cumplirse en una resección endoscópica:
- Lesiones de < 2 cm de tamaño en tipos elevados
- Lesiones de hasta 1 cm de tamaño en tipos planos
- Grado de diferenciación histológico: bueno o moderado (G1/G2)
- Sin ulceración macroscópica
- Invasión limitada a la mucosa
En el caso presentado se trata de un carcinoma en el cuerpo gástrico. Se realiza una gastrectomía con linfadenectomía D2. La reconstrucción se realiza como reconstrucción en Y de Roux sin pouch. Se trata del procedimiento de reconstrucción más frecuentemente realizado en Alemania.