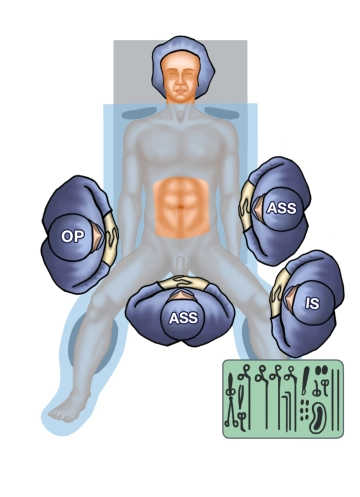
Este procedimiento quirúrgico se utiliza en carcinomas de recto que, en la localización de altura mediante rectoscopia rígida, pueden resecarse con un margen de seguridad de 1 – 2 cm hasta la línea dentada medido desde el borde inferior del tumor.
Para carcinomas de recto en los que no se puede mantener este margen de seguridad o en los que además el esfínter está infiltrado, está indicada la extirpación abdominoperineal del recto. Para carcinomas tempranos (categoría clínica T1, N0, G1 o G2) se puede realizar alternativamente a la resección anterior del recto una escisión local conforme a las guías.
En función de la altura de la anastomosis por encima del esfínter, la reconstrucción después de la resección anterior o anterior profunda del recto se puede realizar como anastomosis colorrectal, coloanal o colo-pouch-anal.
Mediante el establecimiento de la escisión mesorrectal total (TME) como estándar de oro en tumores del tercio medio e inferior se pudo reducir la tasa de recidiva local por debajo del 10%.
En el ejemplo mostrado se trata de un carcinoma del tercio medio del recto (uT3,uN1). Por lo tanto, se realizó conforme a las guías la radioterapia quimioterapéutica neoadyuvante. Después del reestadificación, que no mostró indicios de metástasis a distancia, se estableció la indicación para la resección oncológica del tumor.
Radioterapia neoadyuvante
La radioterapia neoadyuvante se puede administrar con y sin quimioterapia y se recomienda según las guías S3 para el carcinoma de recto en los estadios UICC II (pT3-4 pN0) y III (pT1-4 pN+).
La radioterapia quimioterapéutica neoadyuvante (RCT) dura aproximadamente 6 semanas, seguida de una pausa terapéutica de 6-8 semanas hasta la operación.
La radiación de corta duración neoadyuvante (RT) se administra en 5 días consecutivos. Aquí la operación se realiza después de 2-7 días. Dado que no se espera una reducción del tamaño del tumor, en tumores que alcanzan las fascias envolventes o están cerca del esfínter se prefiere la RCT.
El 27% de los pacientes muestran a través de la RCT una remisión completa histológica. Estos pacientes tienen un pronóstico oncológico particularmente bueno. Dado que la evaluación de la respuesta es difícil y se requiere un EDR (exploración digital rectal), una endoscopia y una RM para la demostración, una estrategia de „watch-and-wait“ solo se puede aplicar en tumores hasta 7 cm desde el ano y preferiblemente en estudios.