Todo hallazgo químico de laboratorio de un hiperparatiroidismo primario (pHPT)
Indicación quirúrgica urgente después de una crisis hipercalcémica
- El término pHPT describe por definición la hipersecreción autónoma primaria de parathormona de una o varias glándulas paratiroides (NSD). Se debe diferenciar de la forma secundaria como consecuencia de una enfermedad subyacente asociada con hipocalcemia (deficiencia de vitamina D, insuficiencia renal crónica).
- Un pHPT ocurre de manera esporádica o hereditaria, generalmente en el contexto de una neoplasia endocrina múltiple (MEN).
Fisiopatología
La regulación hormonal del nivel de calcio está controlada principalmente por la parathormona (PTH, síntesis en las glándulas paratiroides) y la vitamina D3 (1,25-dihidroxicolecalciferol, síntesis del metabolito activo en los túbulos proximales de los riñones). La secreción de PTH por las glándulas paratiroides se regula de manera inversa. Un ligero aumento de la concentración sérica de calcio y la activación asociada de los CaSR resultan en una inhibición de la secreción de PTH. Por el contrario, una concentración baja de calcio estimula la síntesis y secreción de PTH. En pacientes con pHPT, la regulación normal de la secreción de PTH está alterada. A pesar de una concentración sérica de calcio elevada, estos pacientes presentan niveles de PTH desproporcionadamente altos y sufren principalmente de las consecuencias de la hipercalcemia consecutiva.
Epidemiología
En un pHPT, se encuentra en el 85 - 90 % de los casos un adenoma paratiroideo solitario, las mujeres están afectadas 3 - 4 veces más frecuentemente que los hombres. La enfermedad se diagnostica generalmente entre los 55 y 75 años de edad.
Se debe diferenciar de la enfermedad multiglandular, que generalmente tiene una causa genética. Estas formas hereditarias deben identificarse o diferenciarse. El hiperparatiroidismo primario hereditario (hpHPT) afecta frecuentemente a varias glándulas, ya sea como hiperplasia difusa o en forma de múltiples adenomas.
Aproximadamente el 2 - 5 % de todos los casos de pHPT ocurren en el contexto de una neoplasia endocrina múltiple tipo 1 (MEN 1) con igual frecuencia en mujeres y hombres en una edad temprana.
El pHPT es el diagnóstico principal en MEN 1 y se observa casi de manera regular. Aunque en MEN 4 están afectados los mismos órganos primarios que en MEN 1 (glándulas paratiroides,páncreas e hipófisis), los pacientes generalmente se presentan más tarde en la vida y tienen un curso de la enfermedad más indolente que los pacientes con MEN 1. La mayoría de los pacientes con MEN 4 e hiperparatiroidismo tienen adenomas paratiroideos individuales, mientras que en MEN 1 las cuatro glándulas paratiroides son hiperplásicas. MEN 4 es mucho más raro que MEN 1.
También en MEN 2a con tumor principal carcinoma medular de tiroides, ocurre en el 15 - 10 % un pHPT.
En < 1 % de los casos se presenta un carcinoma paratiroideo: A menudo pacientes más jóvenes con pHPT grave, asociación con enfermedades sindrómicas, p. ej. síndrome familiar de HPT-tumor de mandíbula: Esta enfermedad se caracteriza por un pHPT grave y tumores en los huesos maxilares. Los tumores NSD en esta enfermedad son malignos en el 15 - 30 % de los casos.
La presentación del pHPT ha cambiado en las últimas tres décadas de una enfermedad altamente sintomática a una hipercalcemia descubierta accidentalmente, especialmente también debido a la disponibilidad sin problemas de diagnósticos de laboratorio. El diagnóstico de pHPT se realiza hoy al menos 10 años antes que hace 20 años.
Operación
La operación es la única terapia curativa, prácticamente todos los pacientes con pHPT demostrado se benefician de la operación. Debido al espectro de morbilidad de la hipercalcemia, no solo en formas sintomáticas, sino también en asintomáticas, generalmente está indicada la paratiroidectomía.
La detección preoperatoria de una sola glándula paratiroidea agrandada permite un procedimiento quirúrgico enfocado.
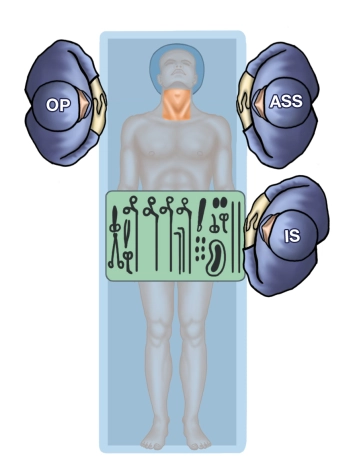
La intervención estándar para el adenoma solitario es la paratiroidectomía mínimamente invasiva abierta demostrada aquí como intervención inicial en pHPT localizado, generalmente combinada con un examen histológico de corte rápido e monitoreo intraoperatorio de PTH. Si el adenoma se localizó preoperatoriamente de manera concordante con ultrasonido y gammagrafía, se puede prescindir del control intraoperatorio del nivel de PTH.
A través de una incisión cutánea de 2 - 3 cm de largo, se extirpa de manera enfocada la glándula paratiroidea afectada. La intervención se realiza exclusivamente en una loja tiroidea. Debido a la ubicación anatómica, la resección de una glándula paratiroidea superior es más difícil que la de una inferior. Si no se encuentra el adenoma o el nivel de PTH no disminuye, se debe explorar bilateralmente e identificar las cuatro glándulas paratiroides.
En caso de sospecha de carcinoma, posiblemente ampliación mediante resección en bloque de las estructuras adyacentes (hematiroidectomía, musculatura cervical recta, tejido blando). Linfadenectomía solo en caso de detección de ganglios linfáticos sospechosos.