El carcinoma de páncreas representa en Europa la cuarta causa de muerte por cáncer más frecuente y se prevé que en el año 2030 ocupará el puesto 2 en la mortalidad por cáncer [1]. La única opción terapéutica potencialmente curativa es la resección quirúrgica, con la que aún se alcanza apenas una tasa de supervivencia a 5 años de solo el 10 % [2]. La biología tumoral agresiva llevó en los últimos 10 años a la introducción de nuevos regímenes quimioterapéuticos más efectivos, tanto adyuvantes como neoadyuvantes, lo que condujo al establecimiento de conceptos terapéuticos multimodales.
Indicación quirúrgica
A iniciativa de la Sociedad Alemana de Cirugía General y Visceral (DGAV), se definieron recomendaciones basadas en evidencia para la indicación quirúrgica del carcinoma de páncreas, por lo que la indicación debe ser establecida por un tumorboard de cirujanos de páncreas experimentados de acuerdo con las directrices, considerando las particularidades individuales del paciente [3]. Según las recomendaciones, que se basan en el análisis sistemático de 58 trabajos originales y 10 directrices, existe una indicación quirúrgica en caso de carcinoma de páncreas probado histológicamente, así como en caso de sospecha alta de un carcinoma de páncreas resecable [3, 4].
Resecabilidad
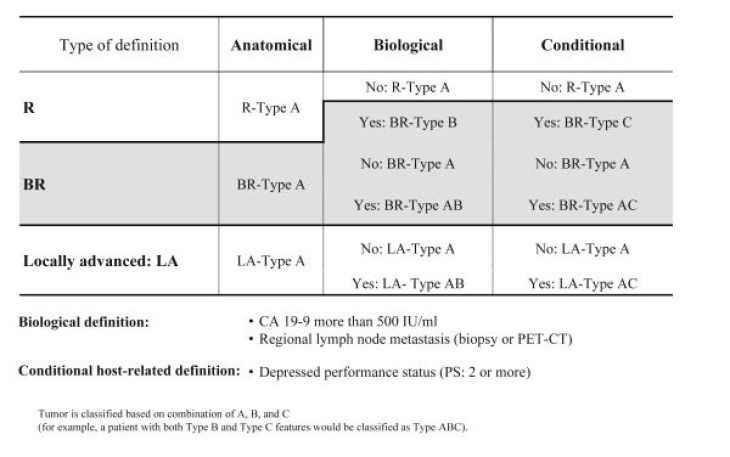
La mayor probabilidad de supervivencia existe con la resección en sano, la resección R0 [5, 6]. En las directrices actuales, la clasificación R0 se divide ahora en „R0 narrow“ (≤ 1 mm) y „R0 wide“ (> 1 mm), si el carcinoma se acerca a menos o más de un milímetro al margen de resección [7]. Además de la resecabilidad anatómica (relación de posición entre el tumor y los grandes vasos viscerales), desde 2017 se consideran la biología tumoral y el estado general del paciente como criterios de resecabilidad decisivos y como clasificación de consenso ABC de la resecabilidad se incorporaron en las directrices S3 actuales [8].
Criterios ABC de la resecabilidad según el consenso de la International Association of Pancreatology (IAP)
(Para ampliar, haga clic por favor)
Fuente: Isaji S et al (2018) International consensus on definition and criteria of borderline resectable pancreatic ductal adenocarcinoma 2017. Pancreatology18(1):2–11.
Para la evaluación de la resecabilidad anatómica , las directrices S3 recomiendan una tomografía computarizada bifásica con contraste [7]. Basándose en los criterios de resecabilidad anatómica, un tumor se puede clasificar en primariamente resecable, borderline resecable („borderline resectable“) y no resecable o localmente avanzado [7].
La evaluación de la resecabilidad biológica se realiza con mayor frecuencia mediante el marcador tumoral CA 19-9. El valor límite se definió como > 500 IU/ml, ya que a partir de este valor la resecabilidad solo está dada en menos del 70 % de los casos y se espera una supervivencia de menos de 20 meses. [8, 9].
Como otro criterio se utiliza el ECOG-Performance-Status como resecabilidad condicional , por lo que los pacientes con un estatus ≥ 2 tienen un mal pronóstico [8].
Mesopáncreas
El mesopáncreas, la región de tejido conectivo alrededor de los grandes vasos de la región pancreática, que está densamente atravesada por vasos sanguíneos y linfáticos, así como por plexos nerviosos, se discute desde hace algunos años [10]. Metaanálisis indican que la resección mesopáncreas total permite mejores resultados oncológicos [11]. En la resección de la cabeza del páncreas, se realiza la eliminación completa del tejido mesopáncreas entre la vena porta, la arteria hepática, la base del tronco celíaco y la A. mesentérica superior (operación Triangle [12, 13]), en las resecciones izquierdas del páncreas (carcinomas del cuerpo y la cola) la pancreatosplenectomía modular antegrada radical (RAMPS [14]).
[RAMPS: Aquí se distingue entre un procedimiento RAMPS anterior y uno posterior según la extensión del tumor, en los que se reseca esencialmente de manera más radical hacia dorsal. En el RAMPS anterior, la resección se realiza incluyendo la fascia de Gerota y la grasa perirrenal en el lado izquierdo. En cambio, en el RAMPS posterior, además de la fascia de Gerota y la grasa perirrenal, se reseca la glándula suprarrenal izquierda.]
Resección vascular
En las resecciones venosas en centros, la morbilidad y la mortalidad están mínimamente aumentadas y se permite una supervivencia global adecuada [15, 16]. Así, según las directrices S3 actuales, se puede realizar una resección vascular de la vena porta en caso de infiltración tumoral ≤ 180° o también en situaciones complejas como una transformación cavernosa con reconstrucción [17]. Las resecciones arteriales, por el contrario, son muy arriesgadas, a menudo complejas y no rara vez requieren también reconstrucciones venosas simultáneas. Los pacientes a menudo no se benefician oncológicamente de las intervenciones extensas y no rara vez muestran datos de supervivencia peores que los pacientes sin resección vascular [18]. Por lo tanto, se debe prescindir de las resecciones arteriales fuera de los centros.
Las resecciones arteriales inesperadas se pueden evitar verificando la ausencia de tumor en la A. mesentérica superior y el tronco celíaco mediante una disección temprana en una resección pancreática con intención curativa. La estrategia „Artery-first“ ayuda a evitar intervenciones frustradas, permite una mejor planificación de las resecciones y reconstrucciones vasculares y mejora la supervivencia a largo plazo en centros con la experiencia correspondiente para pacientes seleccionados [19].
Oligometastatización
El término oligometastatización aparece por primera vez en las directrices S3 actuales y describe la presencia de ≤ 3 metástasis, que solo deben resecarse en el marco de estudios como parte de un concepto de tratamiento multimodal [7]. Hasta ahora no hay estudios randomizados, pero la resección de oligometástasis parece mejorar los datos de supervivencia de los pacientes en comparación con una quimioterapia paliativa, especialmente después de una terapia neoadyuvante [20 - 23]. En Alemania, actualmente los estudios HOLIPANC y METAPANC se ocupan del tema [24].
Conceptos terapéuticos neoadyuvantes
En pacientes con un carcinoma de páncreas borderline resecable, la directriz actual recomienda una quimioterapia preoperatoria o radioterapia quimioterapéutica, en carcinomas resecables no debe realizarse fuera de estudios [7]. Las recomendaciones se basan en los datos de un metaanálisis así como en datos de estudios publicados actualmente [25, 26]. Dado que después de la terapia neoadyuvante la resecabilidad en carcinomas de páncreas borderline resecables iniciales y localmente avanzados es difícil de evaluar por imagen, la directriz recomienda en caso de enfermedad estable una exploración quirúrgica para evaluar una resecabilidad secundaria [7, 27]. En la evaluación de una resecabilidad secundaria, también puede ayudar la caída del valor de CA 19-9 [28. 29].
Técnicas laparoscópicas y robótica en el carcinoma de páncreas
Las resecciones izquierdas del páncreas y las resecciones de la cabeza del páncreas deben considerarse de manera diferenciada. Para las resecciones izquierdas en técnica laparoscópica, el estudio randomizado controlado LEOPARD mostró una convalecencia más rápida, una menor pérdida de sangre y ninguna tasa de complicaciones más alta en comparación con la técnica abierta [30]. En el análisis combinado de los estudios LEOPARD y LAPOPS, se confirmaron los datos [31]. La calidad de vida a largo plazo permanece inalterada por la técnica laparoscópica [32]. Un metaanálisis de los datos existentes resultó en resultados comparables para la tasa de resección R0 y la tasa de quimioterapia adyuvante [33]. La supervivencia global mediana fue de 28 o 31 meses para resecciones izquierdas del páncreas laparoscópicas y abiertas, respectivamente [34].
Para resecciones de la cabeza del páncreas , el estudio randomizado y controlado LEOPARD-2 publicado en 2019 resultó en una mortalidad más alta (mortalidad a 90 días del 10 %) en el grupo laparoscópico, que no mostró ventajas en comparación con el grupo abierto en cuanto a dolor postoperatorio, convalecencia, duración de la estancia hospitalaria y calidad de vida [36]. Un estudio randomizado chino actual resultó en una mortalidad comparable en la resección de la cabeza del páncreas laparoscópica con solo una ventaja marginal de la técnica laparoscópica [37].
La robótica se ha establecido en los últimos 10 años también en la cirugía pancreática. Así, además de la resección izquierda técnicamente más simple, se realiza cada vez más la duodenopancreatectomía. Aquí, sin embargo, se requiere una curva de aprendizaje larga [37] y una evaluación final en cuanto a resultados oncológicos no es posible hasta ahora. Para el uso de la robótica en indicaciones malignas, solo hay estudios observacionales que demuestran la viabilidad y muestran ventajas potenciales de la técnica mínimamente invasiva [38, 39, 40]. Según las directrices internacionales, una indicación maligna no representa una contraindicación fundamental para la robótica, pero se espera que los resultados de estudios randomizados controlados y, por lo tanto, resultados de alta calidad estén disponibles en 3 a 5 años [41].
Centralización de la cirugía pancreática
En centros de alto volumen para cirugía pancreática, se puede reducir la mortalidad postoperatoria y aumentar la supervivencia [42, 43, 44]. Ante este panorama, según la decisión del comité federal conjunto en Alemania, las cantidades mínimas para intervenciones pancreáticas complejas se elevarán a partir de 2024 de las actuales 10 a 20 resecciones por año.
Operación de Whipple versus duodenopancreatectomía con preservación del píloro (PPPD)
Para la resección de carcinomas de la cabeza del páncreas y periampulares, entran en consideración dos procedimientos quirúrgicos, la resección clásica según Kausch-Whipple y la duodenopancreatectomía con preservación del píloro. Esta última tiene la ventaja de la preservación del paso fisiológico de los alimentos y la reducción de síndromes de dumping, pérdida de peso postoperatoria y reflujo [45-52].
Los estudios más recientes [49, 51, 52] pudieron mostrar una tasa de transfusiones más baja y una duración de la estancia hospitalaria menor en pacientes con PPPD en comparación con el grupo de Whipple. La morbilidad postoperatoria no difirió significativamente en ambos grupos. La aparición de trastornos de vaciado gástrico fue comparable en ambos grupos (Whipple 23 % vs. PPPD 22 %). En cuanto a la radicalidad quirúrgica, tampoco se encontró una diferencia significativa (R0-Whipple 82,6 % vs. R0-PPPD 73,6 %). El seguimiento a largo plazo mostró tasas de supervivencia global comparables.