Nota:
El tratamiento postoperatorio posterior debe integrarse en un concepto de Fast-Track como „enhanced recovery after surgery“ (ERAS). Este tiene como objetivo la rápida recuperación y la reducción de las complicaciones postoperatorias, así como de la estancia hospitalaria. Los puntos clave del concepto perioperatorio ERAS son:
- la eutrofia preoperatoria y la normovolemia con una ingesta de líquidos hasta 2 horas preoperatorias
- un manejo anestésico actual y el uso de procedimientos regionales
- la renuncia en la mayor medida posible a drenajes y accesos invasivos
- la técnica quirúrgica mínimamente invasiva y ahorradora de sangre posible
- una terapia del dolor postoperatoria con reducción de la necesidad de opioides
- una movilización temprana
- un inicio temprano de la alimentación
- una planificación de alta oportuna con el uso de un manejo de alta.
Analgesia postoperatoria:
Nota: Para la cuantificación de los dolores postoperatorios están disponibles varias escalas, con cuya ayuda el paciente puede determinar varias veces al día su propio nivel de dolor, como la NRS (escala de calificación numérica 0–10), la VAS (escala analógica visual) o la VRS (escala de calificación verbal).
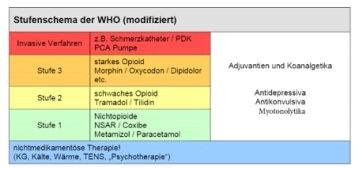
Cave: Apuntar a la renuncia en la mayor medida posible a opioides y AINE (efectos adversos sobre la motilidad intestinal y la curación de las anastomosis)
- PDC a través del servicio de dolor de anestesia 3.er día post Op ex
- Medicación base: Analgesia oral: 4 x 1 g Novalgin/3 x 1 g Paracetamol, también combinable, p.ej. fijo Novalgin y s.n. Paracetamol s.n. hasta 3x/día
- Administración Novalgin: 1g Novalgin en 100 ml solución NaCl durante 10 minutos como infusión corta iv, o 1 g como comprimido oral o 30 - 40 gotas Novalgin oral
- Administración Paracetamol: 1g iv durante 15 minutos cada 8 h, o 1g supositorio cada 8 h rectal (Cave: tener en cuenta la altura de la anastomosis1), o 1g como comprimidos oral
Cave: La medicación base debe adaptarse al paciente (edad, alergias, función renal).
- Medicación según necesidad: En VAS > = 4 s.n. Piritramida 7,5 mg como infusión corta o sc, o 5 mg Oxigesic agudo
- si el dolor persiste post OP > = 4 administración de un opioide retardado (p.ej. Targin 10/5 2 x/día)
Nota: Si los dolores aparecen solo durante la movilización, se debe administrar una medicación según necesidad 20 minutos antes de la movilización.
Nota: Siga aquí el enlace a PROSPECT (Procedures Specific Postoperative Pain Management) así como a la guía actual Tratamiento de dolores perioperatorios agudos y postraumáticos y tenga en cuenta el esquema de niveles de la OMS.
Medidas postoperatorias:
- Vigilancia: post OP: sala de recuperación, renuncia a UCI/IMC si es médicamente posible
- Accesos venosos: CVC hasta 1.er día post Op ex, dejar un catéter periférico,
- Sonda nasogástrica al final de la Op ex
- Catéter: ex hasta 1.er día post OP
- Drenaje ex: Drenaje objetivo ex después de la determinación de enzimas pancreáticas y valores equivalentes al suero a partir del 3.er día post Op
- Movilización: Movilización temprana aún en la tarde de la operación. Reanudación paso a paso de la carga física, carga completa si no hay síntomas, p.ej. El día de la Op en el sillón de siesta, a partir del primer día de pie y caminar en la habitación, a partir del 2.º día post Op movilización en el pasillo
- Fisioterapia
- Entrenamiento respiratorio
- Inicio de la alimentación: Beber a sorbos + yogur/solución bebible hipercalórica el día de la Op, té/sopa/yogur + solución bebible hipercalórica el 1.er día post OP, dieta completa ligera a partir del 2.º día post Op
- Infusión: 500-1000 ml el primer día post Op, después solo si la cantidad de bebida oral es insuficiente
- Antibióticos: Dosis única intraoperatoria, no se requiere administración adicional
- Profilaxis de trombosis: En ausencia de contraindicaciones: en riesgo tromboembólico medio (intervención quirúrgica > 30 min de duración): heparina de bajo peso molecular en dosis profiláctica (por lo general „Clexane 40“), en su caso en dosificación adaptada al peso o al riesgo de disposición hasta alcanzar la movilización completa, medidas físicas, medias de compresión
Nota: Siga aquí el enlace a la guía actual sobre Profilaxis de la tromboembolia venosa (TEV)
Cave: tener en cuenta en la administración de heparina: función renal, HIT II (anamnesis, control de plaquetas),
- En su caso regulación de las heces/actividad intestinal: a partir del 1.er día post OP: Macrogol 1-3 sobres/d, a partir del 3.er día debería haber ocurrido la primera evacuación, mantener potasio en el límite superior normal, esquema de laxantes: 1. Té con Laxoberal/Dulcolax supp, 2.Propulsivos: MCP / Prostigmina i.v., 3. Neostigmina s.c. o iv, en su caso Relistor en administración de opioides
- Laboratorio: el 1.er día post Op, y posteriormente cada 2-3 días en curso normal hasta el alta, en deterioro clínico inmediatamente,
- Perfiles diarios de glucemia
- Enzimas pancreáticas del secreción de drenaje antes de retirar el drenaje, p.ej. El 3.er día post Op
- Vendaje cada 2 días, en vendaje de succión cutáneo cada 5 días
- Asesoramiento nutricional
- Grapas/hilos: si no son reabsorbibles después de 8-10 días ex
- Alta: A partir del 5.º día postoperatorio
- Incapacidad laboral: Incapacidad laboral individual – según el grado de recuperación y el tipo de actividad, p.ej. actividad de oficina después de 3 semanas post Op, trabajo físico después de 4 semanas post Op
- Tratamiento posterior:
- Dependiendo del hallazgo histológico, en enfermedades benignas por lo general no se requiere tratamiento posterior específico
- En diabetes mellitus de nueva aparición: ajuste diabetológico
- Informe médico: El informe médico debe contener información sobre: Diagnóstico, terapia, evolución, histología, enfermedades concomitantes, medicación actual, continuación de la profilaxis de TEV, nutrición postoperatoria
- Tratamiento de rehabilitación posterior (AHB): si es necesario/deseado: inscribir a través del servicio social