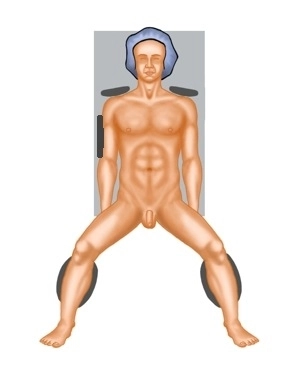
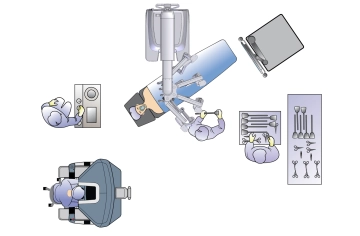
En el carcinoma de recto, la terapia curativa requiere en la mayoría de los casos, además de la resección del tumor primario en tejido sano (es decir, con un margen de seguridad suficiente), la extirpación parcial o total del mesorrecto (PME, TME) y, por lo tanto, la extirpación del área de drenaje linfático regional. Solo en casos estrictamente seleccionados es posible una resección curativa mediante medidas locales.
Las indicaciones para la resección anterior profunda del recto asistida por robot incluyen por lo tanto:
- neoplasia maligna del recto confirmada histológicamente
- tumor no extirpable o no completamente extirpable endoscópicamente con neoplasia intraepitelial de alto grado
- cualquier masa tumoral de mayor profundidad en el recto con una sospecha alta de un proceso maligno
La indicación para el procedimiento quirúrgico en el carcinoma de recto depende fundamentalmente de la localización del tumor, en particular de la relación con la línea dentada y el músculo elevador, de la infiltración en profundidad y de la función del esfínter. Siempre que sea posible, se deben preferir procedimientos que preserven la continencia, considerando la calidad de vida posterior esperada. En caso de una función deficiente del esfínter, en lugar de una resección anterior profunda, se debe preferir la creación de una colostomía permanente, que luego, dependiendo del margen de seguridad que se pueda lograr desde el suelo pélvico, se realiza como extirpación del recto o preservando el suelo pélvico. Si, por lo tanto, no se puede garantizar un margen de seguridad suficiente en dirección aboral mediante una resección anterior profunda del recto, se deben aplicar los siguientes procedimientos según la localización exacta en altura y, en su caso, la infiltración:
- la resección intersfinteriana del recto
- la extirpación abdominoperineal del recto,
Localización | Particularidad | Procedimiento de resección |
tercio superior |
| resección anterior |
tercio medio |
| resección anterior profunda |
tercio inferior |
| |
ultrabajo | sin infiltración del anillo puborrectal, distancia aboral >0,5 cm | resección interesfinteriana |
| Infiltración del anillo puborrectal, distancia aboral <0,5 cm | extirpación abdominoperineal del recto |
En Alemania, las recomendaciones para la terapia del carcinoma de colon y recto están ancladas en la guía S3 (Guía S3 Carcinoma colorrectal (Programa de guías oncológicas (Sociedad Alemana del Cáncer, Ayuda Alemana contra el Cáncer, AWMF): Guía S3 Carcinoma colorrectal. Versión: 30.11.2017. válida hasta 29.11.2022, Consultado el: 14.04.2023)
La siguiente tabla resume los conceptos terapéuticos en función de la situación tumoral y la extensión presentes:
UICC | TNM | Subgrupo | Recomendación terapéutica |
I | T1, N0, MO | <3cm, G1-G2, L0, R0 | excision local suficiente (TEM= microcirugía transanal) |
|
| >3cm o G3 o L1, R1/2 | operación oncológica según localización en altura (TAR, resección interesfinteriana, extirpación (ver abajo) |
I | T2, N0, M0 |
| operación oncológica según localización en altura (TAR, resección interesfinteriana, extirpación (ver abajo) |
II | T3/T4, N0, M0 | tercio superior | TAR |
|
| tercio medio/inferior | radioterapia quimioterapéutica neoadyuvante + |
|
|
| operación oncológica según localización en altura (TAR, resección interesfinteriana, extirpación (ver abajo) |
III | cualquier T, N+, M0 | tercio superior | TAR |
|
| tercio medio/inferior | radioterapia quimioterapéutica neoadyuvante + |
|
|
| operación oncológica según localización en altura (TAR, resección interesfinteriana, extirpación (ver abajo) |
IV | cualquier T, cualquier N, M+ | en principio | Conceptos individualizados |
|
| primario sintomático (sangrado) | resección primaria |
|
| primario sintomático (estenosis) | creación primaria de estoma |
|
| M hep única superficial | Resección posible en el marco de la resección del primario |
|
| M hep extensa resecable | Liver first o Chemo first |
|
| M hep extensa irresecable | terapia sistémica primaria inicial en primario asintomático y concepto "Liver first" |
|
| M per | posiblemente HIPEC en PCI<20 (índice de carcinomatosis peritoneal) |
Notas:
- Una excision de pared completa solo es suficiente en tumores T1 con un diámetro inferior a 3 cm con una diferenciación buena a moderada sin invasión linfovascular y después de resección R0. Sin embargo, también aquí se debe contar con un mayor riesgo de recidiva con una tasa de complicaciones claramente menor y mejores resultados funcionales en general. Técnicamente, se recomienda la microcirugía transanal.
- UICC II y III Las situaciones en tumores del tercio medio e inferior se asignan generalmente a un concepto neoadyuvante con radioterapia o radioterapia quimioterapéutica previa a la operación. El concepto en tumores del tercio superior sigue el del carcinoma de colon (comparar contribución a la resección oncológica del sigma asistida por robot).
- Tumores cT3 del tercio medio sin invasión linfovascular o vascular y con infiltración muy limitada del tejido graso perirrectal en la RM se asignan generalmente también a una operación primaria.
- Respuesta completa: En los (más bien raros) casos en los que después de la radioterapia quimioterapéutica neoadyuvante no se puede detectar tumor clínicamente, endoscópicamente y mediante procedimientos de imagen (endosonografía y RM, alternativamente posiblemente también TC), se puede renunciar a cualquier operación. El requisito para un enfoque puramente observacional es la información exhaustiva del paciente sobre la validación aún insuficiente de este enfoque y la disposición del paciente a someterse a un seguimiento muy estricto de al menos 5 años. La configuración óptima del seguimiento o del „watch & wait“ es objeto de estudios; el siguiente procedimiento de seguimiento puede recomendarse según las directrices de una comisión internacional de expertos: Seguimiento durante 5 años después de la documentación de la cCR; durante tres años cada 3 meses CEA, luego semestral; durante dos años cada 3 meses examen digital-rectal, RM y endoscopia, luego semestral; durante 5 años TC tórax/abdomen superior meses 6,12,24,36,48,60.