El carcinoma de conducto biliar perihilar/central (tumor de Klatskin) se origina en la bifurcación extrahepática del conducto biliar. Debido a la casi ausencia de capa muscular de los conductos biliares, se produce tempranamente una invasión en el parénquima hepático o también en la vena porta.
La única posibilidad de tratamiento curativo es la resección radical R0, que solo se puede lograr mediante una resección en bloque de los conductos biliares, la bifurcación del conducto biliar con resección hepática. En esto, la evaluación de la resecabilidad y el desarrollo de una estrategia de resección adecuada son de la mayor importancia debido a la estrecha relación anatómica posicional con la bifurcación de la vena porta y las arterias hepáticas.
Los enfoques curativos en etapas avanzadas suelen ir acompañados de una pérdida significativa de parénquima hepático y representan un desafío para la cirugía, la anestesia y la medicina intensiva.
Una resección aislada del sistema de conductos biliares extrahepáticos (la llamada „resección de hilio aislada“) no puede considerarse un procedimiento curativo. Como consecuencia, hay tasas de recidiva local del 70-90 % y casi ninguna supervivencia a largo plazo. Predestinados para recidivas locales son los conductos biliares del lóbulo caudado (segmento 1), que regularmente desembocan cerca de la bifurcación del conducto biliar.
Para lograr un margen de seguridad suficiente, siempre es necesaria una resección en bloque simultánea de las porciones centrales del hígado junto con el sistema de conductos biliares. Esto incluye el lóbulo caudado así como las porciones cercanas al hilio de los segmentos 4,5 y 8. Lograr un margen de seguridad proximal y lateral es a menudo problemático debido al crecimiento infiltrante difuso a lo largo de los conductos biliares y las vainas perineurales.
Hasta ahora, se han establecido como procedimientos estándar las hemihepatectomías extendidas, donde en los procedimientos del lado derecho se requiere la llamada resección en bloque hiliar con inclusión de la bifurcación de la vena porta. En los procedimientos del lado izquierdo, debido al curso de la arteria hepática derecha generalmente dorsal al conducto biliar, debe prepararse, por lo que una resección general de la vena porta no está indicada aquí.
En una situación inoperable por razones técnicas o irresecabilidad funcional, el trasplante de hígado representa una opción, aunque con resultados pobres hasta ahora y una escasez flagrante de órganos. Resultados mejorados están disponibles para pacientes seleccionados en un programa de tratamiento multimodal.
Para estas resecciones hepáticas extensas de un órgano previamente dañado por colestasis y por inflamación de los conductos biliares, la evaluación preoperatoria de la función hepática remanente es esencial. Un acondicionamiento del hígado mediante drenaje selectivo de los conductos biliares y antes de resecciones derechas extensas mediante inducción de hipertrofia (embolización de la vena porta/ALPPS) ) es una opción para un mejor resultado.
Especialmente cuando no es posible la inducción de hipertrofia, el procedimiento descrito aquí de una resección hepática central es una variante técnica para la resección radical con preservación máxima simultánea de parénquima hepático sano.
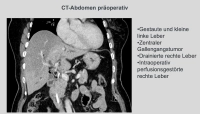
En el caso demostrado, se trata de un tumor de conducto biliar estenosante en la bifurcación hepática Bismuth IIIb, que fue diagnosticado mediante MRCP, ERCP y citología por cepillado.Una resección derecha extendida no era viable debido a la atrofia del lóbulo hepático izquierdo. Por lo tanto, se recurrió a la extirpación de los segmentos hepáticos 1,4,5 y 8 con preservación de los segmentos laterales 6,7 y 2,3, especialmente porque la bifurcación de la vena porta y la arteria hepática izquierda no aparecían infiltradas en la imagen morfológica.